Faktencheck – Kormoran
Verfasser: Dr. Matthias Emmrich, Ralf Gerken, Florian Möllers & Thomas Klefoth (Stand 12-2016)
Zusammenfassung
1. Der Kormoran ist ein heimischer Vogel in Deutschland und auch in Niedersachsen.
2. Spätestens seit den 90er Jahren ist der Vogel in seinem Bestand nicht mehr gefährdet.
3. Der Kormoran ist ein höchst effizienter und flexibler Fischjäger in unseren Gewässern, dessen täglicher Nahrungsbedarf bei durchschnittlich 450-500g Fisch liegt.
4. Auch in natürlichen Still- und Fließgewässern unterschiedlichster Größe werden Fischbestände massiv und nachhaltig durch den Kormoran geschädigt.
5. Die Äsche leidet aufgrund ihrer Lebensweise besonders intensiv unter dem hohen Kormoranbestand und ist aktuell stark gefährdet.
6. Während der Jagd werden Fische durch den Kormoran z.T. schwer verwundet. Quantitative Sterblichkeitsraten von verletzten Fischen, die nicht erbeutet werden konnten, liegen jedoch nicht vor.
7. Der Kormoranbrutbestand in Deutschland liegt bei derzeit ca. 22.550 Brutpaaren. In Niedersachen brüten ca. 1.200 Paare. Der Vogel wird in der Roten Liste Deutschlands und Niedersachsens als „ungefährdet“ geführt.
8. Der Kormoranbestand ist während der jährlichen Nord–Süd Wanderungen an den Binnengewässern um ein Vielfaches höher.
9. Nicht nur der Brutbestand hat sich in den letzten drei Jahrzenten massiv erhöht. Immer mehr Vögel wandern nicht mehr in die südeuropäischen und nordafrikanischen Überwinterungsgebiete, sondern verweilen ganzjährig an deutschen Binnengewässern, sodass der Fraßdruck auf die Fische kontinuierlich hoch ist und sich die Fischbestände nicht mehr erholen können.
10. Renaturierungs- und Vitalisierungsmaßnahmen von Gewässern erzielen häufig bei einem hohen Kormoranbestand häufig keine positiven Effekte für den Fischbestand.
11. Trotz guter Gewässer- und Strukturgüte werden mittlerweile einzelne Fließgewässer nach den Kriterien der Wasserrahmenrichtlinie schlecht bewertet, da durch intensive Kormoranprädation kein guter Zustand bei der Qualitätskomponente Fischfauna ermittelt werden kann.
Der AVN fordert:
1. Fachliche Überprüfung des Schutzstatus nach Bundesnaturschutzgesetz unter Berücksichtigung aktueller Forschungsergebnisse.
2. Aufrechterhalten von Vergrämung und Abschuss von Kormoranen zum Schutz der natürlich vorkommenden Tierwelt und zur Abwendung fischereilicher Schäden - auch in Naturschutz- und FFH–Gebieten, in denen der Kormoran nicht Gegenstand des Schutzzweckes ist.
3. Zukünftig fristlose Verlängerung der KormoranVO in Niedersachsen.
Über welchen Kormoran sprechen wir eigentlich?
Weltweit gibt es 38 Kormoran Arten. Bei uns kommt ausschließlich der Große Kormoran vor, wissenschaftlich Phalacrocorax carbo, was übersetzt in etwa „Schwarzer Glattkopf-Rabe“ bedeutet. Mit bis zu 98 cm Größe und über 3,1 kg Körpergewicht ist er der größte aller Kormorane. Die Männchen werden größer als die Weibchen, die maximal eine Größe von 84 cm und 2,5 kg erreichen (Koffijberg & van Eerden 1995; Liordos & Goutner 2008).
Zwei Unterarten in Europa
Beim Großen Kormoran sind weltweit sieben Unterarten beschrieben, von denen zwei in Europa vorkommen. Die Unterart Phalacrocorax carbo carbo lebt und brütet primär an der atlantischen Küste. Die Unterart Phalacrocorax carbo sinensis (P.c. sinensis) ist die sogenannte Binnenlandrasse, die an den Küsten von Nord- und Ostsee, aber auch bevorzugt im Binnenland zu finden ist. Sinensis ist lateinisch und bedeutet chinesisch. Ist unser Kormoran also nicht heimisch? - NEIN! Die P.c. sinensis Unterart hat die geographisch größte Verbreitung: von Europa, quer über Asien bis nach China und Neuguinea. Behauptungen, bei unserem Kormoran handele es sich um einen nicht heimischen Vogel sind falsch. Prähistorische Knochenfunde von vor über
10.000 Jahren belegen das Vorkommen sowohl von Alt- und Jungvögeln beider Kormoranrassen in Mitteleuropa (Kinzelbach 1998). Ob der Kormoran jedoch regional jemals so weit verbreitet war wie heute, kann anhand der existierenden Datenbasis nicht geklärt werden. Es wird jedoch vermutet, dass z.B. im süddeutschen Raum der Vogel heute so häufig vorkommt wie nie zuvor (LFV Baden-Württemberg 2010).
Warum trägt unser Kormoran den Beinamen „chinesisch“ - Der Irrtum des Herrn Blumenbach Im Jahre 1798 beschrieb der Naturforscher Johann Friedrich Blumenbach basierend auf einer Schwarz-Weiß Kopie eines Kormoran-Kupferstiches, der in London nach einer Chinareise angefertigt worden war, den „Chinesischen Kormoran“. Ein Merkmal war dabei der „weißlichte, braungefleckte Bauch“. Der Irrtum klärte sich ein paar Jahre später auf, nachdem ein farbiger Kupferstich des Vogels veröffentlicht wurde. Hierauf war eindeutig zu erkennen, dass es sich bei dem von Herrn Blumenbach beschriebenen Kormoran um einen Jungvogel des auch in Europa vorkommenden Kormorans handelte, der durch die charakteristische helle Brust gekennzeichnet ist. Da bei der Formulierung von wissenschaftlichen Artnamen das Prinzip der Erstbeschreibung gilt, führt „unser“ Kormoran nun den etwas unpassenden Beinamen „sinensis/chinesisch/aus China stammend“ (nach Kohl 2011). Der korrekte wissenschaftliche Artname, bestehend aus Gattung, Art, Unterart, Erstbeschreiber und Jahr der Erstbeschreibung lautet demnach: Phalacrocorax carbo sinensis (Blumenbach, 1798).
Ein gefährdeter Vogel?
Betrachtet man die sich über zwei Kontinente erstreckende Gesamtpopulation von P. c. sinensis, war diese (Unter)Art nie gefährdet. Doch in Europa wurde der Kormoran intensiv bejagt, sodass er zu Beginn den 20. Jahrhunderts in weiten Teilen nahezu ausgerottet war.
Lediglich in Holland und Polen befanden sich größere Brutkolonien von etwa 3.000 - 4.000 Brutpaaren. Bis Anfang der 70er Jahre war der Kormoran ein sehr seltener Gast an deutschen Gewässern. Der europäische Brutbestand belief sich auf weniger als 5.000 Brutpaare (Bregnballe et al. 2003).
Dann begann sich die Population zu erholen, und mit dem Inkrafttreten der EG-Vogelschutzrichtlinie 1979, die einen Totalschutz des Vogels und seiner Brutstätten garantierte, begann in den 80er Jahren ein exponentielles Wachstum des Bestandes. Innerhalb von nur zehn Jahren verzehnfachte sich die Population. Ende der 90er Jahre gab es in Europa bereits ca. 180.000 Brutpaare. Aktuellste Zahlen (2012/2013) geben einen Brutbestand für die Binnenlandrasse (P.c sinensis) in den 28 EU-Mitgliedsstaaten von 214.800 Brutpaaren an (Bregnballe et al. 2014). Von einer Gefährdung des Kormoranbestandes kann auch in Mitteleuropa spätestens seit den 90er Jahre nicht mehr gesprochen werden.
Bestand in Deutschland
Der Bestand nahm in Deutschland analog zum europäischen Gesamtbestand eine ähnliche Entwicklung. Bis Anfang der 70er Jahre gab es nur sehr wenige Brutpaare in kleinen Brutkolonien, die häufig ihren Standort wechselten. In den 80er Jahren gab es zunehmend mehr und auch dauerhaft etablierte Koloniestandorte, und es kam zur Neugründung weiterer Kolonien (Kieckbusch & Knief 2007). 1990 wurden in Deutschland 5.750 Kormoranbrutpaare an 22 Brutstandorten gezählt. Innerhalb von nur fünf Jahren verdreifachte sich die Population auf ca. 15.000 Brutpaare an 64 Brutstandorten. Im Jahr 2001 wurden in Deutschland 20.000 Brutpaare in knapp 100 Kolonien nachgewiesen (Bregnballe et al. 2003). Die neuesten Zahlen (2012) nennen 22.550 Brutpaare verteilt auf 150 Kolonien (Kieckbusch 2014). Die meisten Vögel nisten in Mecklenburg Vorpommern (51 %), Schleswig–Holstein (11 %) und Niedersachsen (7 %).
Bestand in Niedersachsen
In Niedersachsen ist eine jährliche Brut des Kormorans seit 1941 dokumentiert (Heckenroth & Laske 1997), jedoch gab es kaum Brutpaare. So wurden Anfang der 70er Jahre weniger als 50 Brutpaare registriert. Erst Mitte der 80er Jahre kam es zu vermehrten Neugründungen von Brutkolonien (Heckenroth & Laske 1997) und zu einem Anstieg der Brutpaare auf ca. 130 im Jahr 1985 und ca. 750 in 1995 (Südbeck 1997). Im Jahr 2005 wurden bereits 1.450 Brutpaare gezählt. Die aktuellsten Zählungen belaufen sich auf ca. 1.200 Brutpaare (nach Daten der Staatlichen Vogelschutzwarte Nds.). Neben den Brutpaaren steigt die Zahl der Kormorane in Niedersachsen um ein Vielfaches während der Herbst- und Wintermonate um ein Vielfaches an (vgl. Der Kormoran - ein Zugvogel).
Schutzstatus & Kormoranverordnung
Der Kormoran genießt den allgemeinen Schutzstatus durch die EG-Vogelschutzrichtlinie. Auch nach dem Bundesnaturschutzgesetz ist der Kormoran eine besonders geschützte Art. Das bedeutet, dass dem Vogel nicht nachgestellt werden und er nicht gefangen, verletzt oder getötet werden darf. Darüber hinaus dürfen seine Fortpflanzungs- oder Ruhestätten nicht beschädigt oder zerstört werden, und der Kormoran darf während seiner Fortpflanzungs- und Aufzuchtzeiten nicht erheblich gestört werden. Diese Regelung ist weiterhin gültig, obwohl die Rote Liste der gefährdeten Tierarten Deutschlands den Kormoran bereits seit 1996 als „ungefährdet“ einstufte. Auch in der Roten Liste der Brutvögel Niedersachsens wird der Kormoran seit 2002 als „ungefährdet“ geführt. Ein Schutzstatus ist folglich sowohl international als auch national und regional nicht mehr nötig.
Im Falle erheblicher fischereiwirtschaftlicher Schäden ist es den Bundesländern gestattet, Ausnahmegenehmigungen zum Abschuss oder zur Vergrämung von Kormoranen zu erlassen. Das erfolgt über die sogenannten Kormoranverordnungen. Die Kormoranverordnung in Niedersachsen erlaubt den Abschuss der Vögel zur Abwendung erheblicher fischereiwirtschaftlicher Schäden und zum Schutz der natürlich vorkommenden Tierwelt. Vom 01.08. - 31.03. eines jeden Jahres dürfen adulte Kormorane in einem Umkreis von 500 m um Teichwirtschaften und an oberirdischen Gewässern mit Fischereirecht getötet oder vergrämt werden. Individuen, die sicher als Jungvögel zu erkennen sind (immatur, braun-weißlich gefärbte Tiere), dürfen ganzjährig getötet werden. Zukünftig sollen immatur gefärbte Kormorane, die am Brutgeschäft teilnehmen, geschützt werden. Allgemein ausgenommen sind Tötungen und Vergrämungen von Kormoranen in Nationalparks und in Naturschutzgebieten. Hier bedarf es einer behördlichen Ausnahmegenehmigung.
Der Kormoran – Ein Zugvogel
Der Binnenlandkormoran ist ein ausgesprochener Wandervogel, der jährliche Nord-Südwanderungen unternimmt. Die Überwinterungsgebiete befinden sich vielfach in Südeuropa und weiter bis nach Nordafrika (Rutschke 1998). Die Kormoranwanderung beginnt bereits im Juli aus den nördlichen Brutgebieten. Die Vögel wandern verhältnismäßig langsam nach Süden und legen immer wieder Stopps an den Binnengewässern ein. Viele Vögel aus Dänemark, anderen Teilen Skandinaviens und aus Deutschland überwintern seit der Klimaerwärmung mittlerweile viel weiter nördlich und somit auch in Deutschland (Bregnballe et al. 1997). Dies ist ein wesentlicher Grund dafür, dass in den Herbst- und Wintermonaten vermehrt Kormorane an den Binnengewässern zu beobachten sind. Aktuelle Untersuchungen zeigen, dass sich das Wanderverhalten der Kormorane in Deutschland über die Jahrzehnte stark verändert hat. Der Anteil von Individuen, die weniger als 500 km wandern, steigt kontinuierlich an. Waren es in den 90er Jahren lediglich 12%, liegt der Anteil der Geringdistanzwanderer derzeit bei ca. einem Drittel (Herrmann et al. 2015). Somit hat sich nicht nur die Zahl der Kormoranbrutpaare seit den 90er Jahren dramatisch erhöht, ein wesentlicher Teil der Population verweilt mittlerweile ganzjährig in Deutschland. Es haben sich neue Überwinterungsgebiete etabliert, und es werden zunehmend binnenländische Überwinterungsgebiete aufgesucht (Herrmann et al. 2015). Der Prädationsdruck auf die Fischbestände in den Binnengewässern ist so über einen Großteil des Jahres gleichbleibend auf hohem Niveau, eine Erholung der Beutefischbestände daher vielfach nicht mehr möglich.
Ist ein Nahrungsbedarf von 500 g Fisch pro Tag und Kormoran realistisch?
Kaum ein Thema wird so kontrovers diskutiert, wie der tägliche Nahrungsbedarf des Kormorans. Der Kormoran ernährt sich fast ausschließlich von Fisch. Als Faustregel werden zumeist 500 g Fisch pro Tag angegeben, auch wenn es deutliche Schwankungen nach oben sowie nach unten gibt. Anhand einer Übersichtsarbeit von Ridgeway et al. (2010), die die Ergebnisse von Nahrungsuntersuchungen an Kormoranen zusammengefasst hat, wurde ein täglicher Nahrungsbedarf während der Brutzeit von ca. 540 g und außerhalb der Brutzeit von 440 g angenommen. Somit sind die 450 - 500 g Fisch, die ein Kormoran durchschnittlich pro Tag frisst, als realistisch einzuschätzen. Der Jahresbedarf eines Kormorans liegt entsprechend bei 164 - 183 kg Fisch. Ein Nahrungsbedarf von durchschnittlich unter 400 g pro Tag und Vogel ist folglich stark untertrieben.
Wieviele der Fische, die der Kormoran nicht fressen konnte, aber verletzt hat, verenden?
Häufig findet man Angaben, dass mindestens nochmals die gleiche Menge Fisch durch Kormorane verletzt wird und anhand der Verletzungen verendet. Diese Aussagen entbehren einer wissenschaftlichen Grundlage und sind somit nicht völlig korrekt, denn die genauen Zahlen infolge von Bissverletzungen verendeter Fische lassen sich faktisch nicht beziffern. Außer Frage steht jedoch, dass größere Fische häufiger gravierende Verletzungen durch Kormorane davontragen und somit anfällig für parasitäre Infektionen und Nekrosen sind, die auch zum Tode führen können (Adámek et al. 2007; Kortan et al. 2008; Abb. 1). Untersuchungen an Aalen am Dümmer haben gezeigt, dass mit steigender Fischgröße auch die Häufigkeit von Bissspuren zunimmt. Beispielsweise wurden im September 2008 bei über 68 % der untersuchten Aale Bissspuren nachgewiesen (Emmrich & Düttmann 2010). Durch ihre Jagd können Kormorane auch indirekte Massensterben von Fischen auslösen, indem sie Fische z.B. in sauerstofffreie Gewässerbereiche von tiefen Seen jagen, wo sie dann ersticken (Dettmann 2014).

Abb.1: Fische, die im Rahmen einer Bestandsbergung in der Leine bei Hannover gefangen wurden. Deutlich sind die Bissverletzungen, verursacht durch Kormorane, und die nachfolgenden Verpilzungen zu erkennen. Fotos: © M. Emmrich / AVN
Ein effizienter, flexibler Unterwasserjäger
Kormorane gelten unter den fischfressenden Vögeln als die effizientesten Jäger in unseren Gewässern. Jedoch können sie unter Wasser nicht besonders gut sehen. Erst im Nahbereich von ca. einem Meter, was natürlich abhängig von Lichtregime und der Gewässertrübung ist, können die Vögel ihre Beute gut wahrnehmen (Strod et al. 2004; White et al. 2007). Kleine Fische werden bereits unter Wasser verschluckt, bei größeren Individuen müssen die Vögel auftauchen, um ihre Beute zu schlucken (Strod et al. 2003). Dass Kormorane keine Probleme damit haben auch große Beute zu überwältigen, zeigen die vielen Nahrungsuntersuchungen. So wurden Aale von über 65 cm, Zander und Hechte bis fast 40 cm, Rotauge über 30 cm und hochrückige Brassen von fast 36 cm bei Nahrungsanalysen gefunden (Dirksen et al. 1995; Wziatek et al. 2003; Emmrich & Düttmann 2010).
In sehr trüben Gewässern jagen die Vögel häufig im Schwarm mit z.T. mehreren hundert Vögeln. Sie treiben die Fische ins flache Wasser und können sie so effizient fressen (van Eerden & Voslamber 1995). Die Gewässertiefe spielt bei der Jagd für den Kormoran keine wichtige Rolle.
Die Rekordtauchtiefe ist mit 63 m angegeben (Totfund im Maränennetz im Bodensee, Kohl 2011), aber auch in sehr flachem Wasser sind die Fische nicht vor dem Kormoran geschützt. Görner (2008) beobachtete Kormorane in flachen Rauschen eines Fließgewässers bei der Jagd auf Kleinfische (Mühlkoppen und Schmerlen), indem sie im Wasser stehend mit dem Schnabel Steine bewegten, um die darunter befindlichen Fische zu erbeuten.
Nach der erfolgreichen Jagd – Flügelspreizen
Häufig sieht man Kormorane mit gespreizten Flügeln am Gewässer sitzen. Es werden verschiedene Ansätze diskutiert, warum die Vögel dieses Verhalten zeigen. So kann die produzierte Wärme durch erhöhte Muskelaktivität während des Flügelspreizens die Verdauung erleichtern. Ein anderer Ansatz diskutiert eine Art soziale innerartliche Kommunikation, die eine erfolgreiche Fischjagd anzeigt (Grémillet 1995; White et al. 2008). Hauptsächlich spreizen die Vögel jedoch ihre Flügel, um das Gefieder nach der Jagd zu trocknen (White et al. 2008). Im Vergleich zu anderen Wasservögeln ist das Gefieder der Kormorane weniger wasserabweisend, womit das spezifische Gewicht des Vogels erhöht wird und er so effizienter tauchen kann (Grémillet et al. 2005). Ein vergleichsweise geringer Anteil luftgefüllter Hohlräume in den Knochen und der somit geringere Auftrieb erleichtert das Tauchen zusätzlich. So liegen die Vögel verhältnismäßig tief im Wasser, sodass der Beobachter schon bei leichtem Wellengang auf den Gewässern, lediglich den Kopf des Kormorans sieht.
Kein Einfluss von Kormoranen auf natürliche Fischbestände?
Die Behauptung, der Kormoran verursache Schäden an Fischbeständen lediglich in Teichwirtschaften, während in natürlichen Gewässern kein negativer Einfluss dokumentiert sei, ist falsch! Zahlreiche wissenschaftliche Fallstudien belegen mittlerweile einen negativen Einfluss des Kormorans auf einzelne Fischarten, auf ganze Fischbestände und auch auf komplette ökosystemare Prozesse - und das sowohl in Still - als auch in Fließgewässern verschiedener Größe. Für zahlreiche Fischarten liegen Studien vor, die eindeutige Nachweise erbringen für die durch Kormoranfraß herbeigeführte erhebliche Dezimierung ihrer Bestände:
Äsche (Staub 1997), Bach- und Meerforelle, Lachs (Kennedey & Greer 1988; Koed et al. 2006), Große Maräne (Winfield et al. 2003), sowie die aus ökosystemarer Sicht wichtigen Raubfischbestände von Hecht (Delmastro et al. 2015), Zander (Emmrich & Düttmann 2011) und Flussbarsch (Skov et al. 2014).
Aufgrund ihres Lebenszyklus und ihres Verhaltens leidet die Äsche ganz besonders unter dem Kormoran. Als nicht strukturgebundene Fischart, die sich gerne im Freiwasser mittelgroßer Fließgewässer aufhält, wird sie zur leichten Beute; insbesondere im Winter und während der Laichzeit, wenn die Fische größere Schwärme bilden (Staub 1997; Conrad et al. 2002; Schwevers & Adam 2003). Aktuelle Studienergebnisse aus Dänemark konnten zeigen, dass von 24 besenderten Äschen, 21 Tiere über den Winter gestorben sind.
Als Hauptursache für die hohe Sterblichkeit konnte der Kormoran ausgemacht werden (Ravn & Jepsen 2016). Auch in Gewässern in Sachsen-Anhalt wurde ein Rückgang der Äschenbestände um 80 bis 100 % dokumentiert und das, obwohl zeitgleich umfangreiche Fließgewässerrenaturierungen und Lebensraumverbesserungen stattgefunden haben (Ebel 2012).
Aber nicht nur in Fließgewässern lässt sich der negative Kormoraneinfluss dokumentieren. Selbst in natürlichen Großgewässern wie dem Dümmer mit über 1.000 ha zeigen sich die negativen Auswirkungen intensiver Kormoranprädation auf natürliche Fischbestände. Aufgrund der intensiven Kormoranprädation ist der für das Ökosystem so wichtige Raubfischbestand im Dümmer nahezu komplett zusammengebrochen (Kämmereit et al. 2005; Emmrich & Düttmann 2010).
Abbildung 2 zeigt ein typisches Bild einer stark kormoranbeeinflussten Fischpopulation am Beispiel des Zanders im Dümmer See. Nachwuchs und große Laichtiere sind vorhanden, der Mittelbau fehlt hingegen komplett. Bei anhaltend intensiver Kormoranprädation kann sich der Bestand offensichtlich nicht mehr erholen. Deutlich lässt sich die Größenverschiebung im Laichtierbestand über die Jahre hin zu immer größeren Individuen erkennen. Während im Jahr 2000 noch Laichfische ab einer Größe von 55 cm nachgewiesen wurden, konnten zwölf Jahre später nur noch Individuen über 67 cm nachgewiesen werden. Tiere zwischen 15 und 66 cm wurden überhaupt nicht gefangen (2).
Als Fischereirechteinhaber hat der Anglerverband Niedersachsen reagiert und für die Raubfische im Dümmer eine Entnahmefensterregelung eingeführt, die die großen Laichtiere schont. Sie dürfen dem Gewässer nicht entnommen werden.
Dass der Kormoran im Wesentlichen für die starken Zanderverluste im Dümmer verantwortlich ist, zeigten Nahrungsanalysen anhand von Speiballen, in denen Jungzander im Spätsommer einen Anteil von über 60 % in der Kormorannahrung ausmachten (Emmrich & Düttmann 2011).
Eine Hochrechnung ergab, dass innerhalb von nur zwei Monaten im Jahr 2008 über 8,7 Tonnen Jungzander im Dümmer von den Kormoranen gefressen wurde (Emmrich & Düttmann 2011)
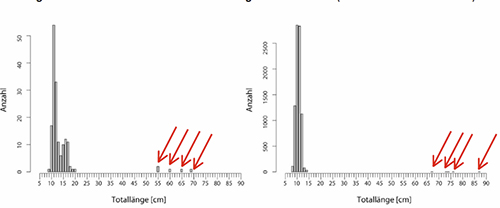
Abb. 2 Längen-Häufigkeitsverteilung mittels Kiemen- und Schleppnetz gefangener Zander im Dümmer 2000 (links) und 2012 (rechts).
Deutlich ist die Verschiebung der Elterntiergröße zu erkennen. Sterben diese Fische, wird der bestand voraussichtlich kollabieren, da durch den Kormoranfraß keine neuen Laichtiere heranwachsen können. Daten nach Kämmereit et al. 2005; Hop & Kampen 2012.
Durch eine starke Prädation auf Raubfische kann das Nahrungsnetz in Seen destabilisiert werden, was sich nachteilig auf die Wasserqualität auswirken kann (Skov et al. 2014). Ganze nahrungsnetze werden auch in Fließgewässern durch Kormoranprädation massiv beeinträchtigt. So begünstigt das nahezu komplette Verschwinden großwüchsiger Fische wie Äsche, Döbel, Nase und Barbe aufgrund des Kormoraneionflusses die Massenentwicklung von Kleinfischarten. Die Folge kann eine verstärkte Algenproduktion im Gewässer sein, was sich wiederum nachteilig auf kieslaichende Fischarten wie Lachs, Forelle und Äsche auswirken kann (Stemmer 2012)
Gewässerrenaturierung / -vitalisierung als eine Methode, Fischbestände vor Kormoranschäden zu schützen?
Viele unserer Gewässer weisen nach wie vor strukturelle Defizite auf, sodass Renaturierungen/Vitalisierungen unabdingbar sind, um gesunde Fischbestände zu fördern.
Vielfach werden Argumente herangezogen, dass Kormorane nur Schäden an natürlichen Fischbeständen in vom Menschen überformten Gewässern verursachen, da solche strukturarmen Gewässer es dem Kormoran sehr leicht machen, Fische überhaupt zu erbeuten. Immer mehr Studien belegen mittlerweile jedoch das Gegenteil: In naturnahen und aufwendig renaturierten Fließgewässerabschnitten ist der Fischbestand zum Teil extrem gering, während in den ausgebauten, naturfernen städtischen Gewässerbereichen gute Fischbestände vorzufinden sind (Wunner & Wismath 2004; Ebel 2012; Schneider et al. 2015), genau die Gewässerbereiche, in denen die Kormorane nicht jagen. Die Gewässerstruktur hat keinen wesentlichen Einfluss auf den Jagderfolg der Kormorane.
Eingebrachtes Totholz in Still– und Fließgewässer wirkt sich bei starker Kormoranpräsenz also nicht zwingend positiv auf Fischbestände aus, da Kormorane selbst in diesen Strukturen die Fische effizient erbeuten können (Becker 2007; Baer & Konrad 2010).
Geht man davon aus, dass die Fischfauna als Indikator für den ökologischen Zustand eines Gewässers in Bezug auf die Gewässergüte und -struktur geeignet ist, verliert der Indikator seine Aussagekraft, wenn durch Kormoranprädation Fischarten in ihrer Häufigkeit und Altersstruktur massiv beeinträchtig werden (Stemmer 2012). Unzählige Beispiele zeigen, dass sich der Fischbestand trotz erfolgter Renaturierungsmaßnahmen nicht erholen kann bzw. sich der ökologische Zustand gemessen anhand der Fischartengemeinschaft nicht verbessert, solange das Gewässer regelmäßig von Kormoranen frequentiert wird (Schneider et al. 2015; Ebel 2012; Baer & Konrad 2010).
Position des Anglerverbandes Niedersachsen zur geplanten neuen Kormoranverordnung in Niedersachsen
Der Anglerverband Niedersachsen begrüßt im Grundsatz, dass die Niedersächsische Kormoranverordnung (NKormoranVO) vom 09.06.2010 verlängert werden soll. Zum Schutz der natürlich vorkommenden Tierwelt und zur Abwendung erheblicher fischereiwirtschaftlicher Schäden halten wir eine allgemeine Zulassung des Tötens und Vergrämens von Kormoranen in Niedersachsen für unabdingbar.
Der § 2 Abs. 2, Nr. 2 und 3. der alten wie auch der geplanten Kormoranverordnung sieht vor, dass ein Kormoranabschuss bzw. eine Kormoranvergrämung in Nationalparks, Naturschutzgebieten oder in Natura–2000–Gebieten grundsätzlich unzulässig sei und Ausnahmen nur gemäß den Bestimmungen des §7 NKormoranVO zu erteilen seien. Dies ist nach unserer Einschätzung eine Übermaßregelung, die die konkreten Regelungen und Erfordernisse der individuellen Schutzgebiete nicht berücksichtigt. Zudem ist über den §2 Abs. 3 sichergestellt, dass die Schutz– und Erhaltungsziele des jeweiligen Gebietes nicht durch die Kormoranverordnung beeinträchtigt werden.
War also in einem Naturschutz– oder FFH–Gebiet ein Schutz des Kormorans nicht erforderlich, bedarf es keiner allgemeinen Ausnahme in der Kormoranverordnung. Die Ausnahme erscheint auch dann nicht erforderlich, wenn der Vogelschutz / Kormoranschutz nicht Gegenstand des Schutzzweckes ist oder aber die Reduzierung von Kormoranen zum Schutz seltener und gefährdeter Fische geboten erscheint.
Wegen denkbar unterschiedlicher Fallkonstellationen bedarf es also einer gebietsbezogenen Regelung, die in der Schutzgebietsverordnung zu erfolgen hat und nicht über eine pauschalisierende und nivellierende Kormoranverordnung. In besonderen Einzelfällen bleibt zudem die Möglichkeit für die Naturschutzbehörde, den Kormoranabschuss zu beschränken.
Sorge bereitet uns, dass von Seiten der Landesregierung angedacht ist, die Kormoranverordnung nach ihrem Ablauf in Frage zu stellen, wenn Schäden an kommerziellen Teichwirtschaften finanziell ausgleichbar sind bzw. Maßnahmen zur Einhausung von Teichen greifen. Damit wird die Problematik freier Gewässer mit wildlebenden Fischpopulationen komplett ausgeblendet.
Zudem ist die Begrenzung der Kormoranverordnung auf drei Jahre unserer Auffassung nach viel zu kurz, um belastbare Evaluationsergebnisse zu liefern, welche im Anschluss eine Neubewertung der Sachlage erlauben würde.
Wir fordern daher, die Evaluation konkret auch auf die Gefährdungssituation wildlebender Fischpopulationen auszurichten. Insbesondere die Äsche ist durch den Kormoran beeinträchtigt und bedarf als Art mit höchster Handlungspriorität in der niedersächsischen Artenschutzstrategie besondere Beachtung.
In der bisherigen Kormoranverordnung durften immatur gefärbte Kormorane, die anhand ihres braun–weißen Brustgefieders als solche sicher zu erkennen sind, ganzjährig getötet werden. In der neuen Verordnung wird ergänzt: „dies gilt nicht für Tiere, die am Brutgeschäft teilnehmen“. Wissenschaftliche Studien belegen, dass Jungvögel im ersten Lebensjahr nur in absoluten Ausnahmefällen bereits selber brüten. Normalerweise werden Kormorane mit zwei bis vier Jahren geschlechtsreif (Kortlandt 1995, Frederiksen & Bregnballe 2001; Bregnballe 2006). Existieren überhaupt Daten zur Brutbeteiligung immatur gefärbter Vögel, die diese Einschränkung rechtfertigen? Nach unserer intensiven Literaturrecherche und Gesprächen mit Experten ist das Gegenteil der Fall, und die Frage kann fast immer mit NEIN beantwortet werden.
Literatur
Deutschsprachige Übersichtsarbeiten zum Kormoran liegen u.a. vor von
Guthörl V. (2006)
Zum Einfluss des Kormorans (Phalacrocorax carbo) auf Fischbestände und aquatische Ökosysteme: Fakten, Konflikte und Perspektiven für kulturlandschaftsgerechte Wildhaltung. Wildland Weltweit Verlag, Frankreich/Deutschland.
Kohl F. (2011)
Kormorane und Fische Naturschutz und Fischerei – Fakten und Argumente zu einem lösbaren Problem. Österreichisches Kuratorium f. Fischerei und Gewässerschutz. 166 S.
Adámek Z., Kortan J., & Flajšhans M. (2007)
Computer-assisted image analysis in the evaluation of fish wounding by cormorant [Phalacrocorax carbo sinensis (L.)] attacks. Aquaculture International 15, 211-216.
Baer J. & Konrad M. (2010)
Eintrag von Totholz in Fließgewässern – eine Methode zum Schutz von Fischbeständen vor der Prädation durch Kormorane? Vogelwarte 48, 15-20.
Becker A. (2007)
Totholzprojekt am Knielinger See Totholzeintrag zum Schutz von Fischen vor Kormoranen? Studie im Auftrag des Anglerverein Karlsruhe e.V..
Bregnballe T. (2006)
Agerelated fledgling production in great cormorants Phalacrocorax carbo: influence of individual competence and disappearance of phenotypes. Journal of Avian Biology, 37, 149-157.
Bregnballe T., Engström H., Knief W., van Eerden M.R., van Rijn S., Kieckbusch J.J., & Eskildsen J. (2003)
Development of the breeding population of great cormorants Phalacrocorax carbo sinensis in the Netherlands, Germany, Denmark, and Sweden during the 1990s. Vogelwelt 124 Supplement, 15-26.
Bregnballe T., Frederiksen M., & Gregersen J. (1997)
Seasonal distribution and timing of migration of cormorants Phalacrocorax carbo sinensis breeding in Denmark. Bird Study 44, 257-276.
Bregnballe T., Lynch A., Parz-‐Gollner R., Marion L., Volponi S., Paquet J.-Y., Carss D.N., & van Eerden M.R. (2014)
Breeding numbers of great cormorants Phalacrocorax carbo in the Western Palearctic, 2012-2013. IUCN-Wetlands International Cormorant Research Group Report. - Scientific Report from DCE – Danish Centre for Environment and Energy No. 99, 224 pp.
Conrad B., Klinger H., Schulze-Wiehenbrauck M., & Stang C. (2002)
Kormoran und Äsche - ein Artenschutzproblem. LÖBF Mitteilungen 27, 46-54.
Delmastro G.B., Boano G., Conte P.L., & Fenoglio S. (2015)
Great cormorant predation on Cisalpine pike: a conservation conflict. European Journal of Wildlife Research, 1-6.
Dettmann L. (2014)
Kormorane lösen Massensterben von Jungfischen der Kleinen Maräne im Parsteiner See aus. Der Märkische Angler 4, 36.
Dirksen, Boudewijn T.J., Noordhuis R., & Marteijn E.C.L. (1995)
Cormorants Phalacrocorax carbo sinensis in shallow eutrophic freshwater lakes: Prey choice and fish consumption in the non-‐breeding period and effects of large-‐scale fish removal. Ardea 83, 167-184.
Ebel G. (2012)
Zum Einfluss des Kormorans (Phalacrocorax carbo sinensis) auf Fischbestände in Fließgewässern Sachsen-Anhalts. Naturschutz im Land Sachsen-Anhalt 49, 26-39.
Frederiksen M. & Bregnballe T. (2001)
Conspecific reproductive success affects age of recruitment in a great cormorant, Phalacrocorax carbo sinensis, colony. Proceedings: Biological Sciences, 268, 1519-1526.
Van Eerden M.R. & Voslamber B. (1995)
Mass fishing by cormorants Phalacrocorax carbo sinensis at LakeIjsselmeer, the Netherlands A recent and successful adaptation to a turbid environment. Ardea 83,199-212.
Emmrich M. & Düttmann H. (2010)
Untersuchungen zur Nahrungswahl des Kormorans (Phalacrocorax carbo sinensis) am Dümmer (Landkreis Diepholz, Niedersachsen) unter besonderer Berücksichtigung von Aal (Anguilla anguilla) und Zander (Sander lucioperca). Osnabrücker Naturwissenschaftliche Mitteilungen 36, 55-67.
Emmrich M. & Düttmann H. (2011)
Seasonal shifts in diet composition of great comorants Phalacrocorax carbo sinensis foraging at a shallow eutrophic inland lake. Ardea 99, 207-216.
Görner M. (2008)
Zum Verhalten des Kormorans (Phalacrocorax carbo) an und in Fließgewässern des Binnenlandes. Acta Ornithoecologica 6, 131-142.
Grémillet D. (1995)
“Wing-Drying” in Cormorants. Journal of Avian Biology 26, 176.
Grémillet D., Chauvin C., Wilson R.P., Le Maho Y., & Wanless S. (2005)
Unusual feather structure allows partial plumage wettability in diving great cormorants Phalacrocorax carbo. Journal of Avian Biology 36, 57-63.
Heckenroth H. & Laske V. (1997)
Atlas der Brutvögel Niedersachsens 1981-1995. – Naturschutz und Landschaftspflege in Niedersachsen 37, 1-329.
Herrmann C., Wendt J., Köppen U., Kralj J., & Feige K.-D. (2015)
Veränderungen im Zugverhalten des Kormorans Phalacrocorax carbo sinensis von den 1930er Jahren bis in die Gegenwart. Vogelwarte 53, 139-154.
Hop J. & Kampen J. (2012)
Fish stock estimation Dümmer See. Studie im Auftrag des LAVES, Derzernat Binnenfischerei.
Kennedey G. & Greer J.E. (1988)
Predation by cormorants, Phalacrocorar carbo (L.), on the salmonid populations of an Irish river. Aquaculture and Fisheries Management, 19, 159-170.
Kortlandt A. (1995)
Patterns of pair-‐formation and nest-‐building in the European cormorant Phalacrocorax carbo sinensis. Ardea, 83, 11-25.
Kämmereit M., Matthes U., Werner R., & Belting H. (2005)
Zur Entwicklung der Fischbestände im Dümmer. Arbeiten des deutschen Fischereiverbandes 82, 7-39.
Kieckbusch J.( 2014)
Status of the breeding population of Great Cormorants in Germany in 2012. – In: Bregnballe T., Lynch J., Parz-‐Gollner R., Marion L., Volponi S., Paquet J.-‐Y., Carss D.N. & van Eerden, M.R. (eds.): Breeding numbers of Great Cormorants Phalacrocorax carbo in the Western Palearctic, 2012-2013. – IUCN-Wetlands International Cormorant Research Group Report. Scientific report from DCE – Danish Centre for Environment and Energy, Aarhus University 99, 113-116.
Kieckbusch J. & Knief W. (2007)
Brutbestandsentwicklung des Kormorans (Phalacrocorax carbo sinensis) in Deutschland und Europa. Fachtagung Kormorane 2006. BfN-‐Skripten 204, 28-47.
Kinzelbach R. (1998)
Kormorane im Binnenland Mitteleuropas - eingeschleppt oder alt eingesessen? - Der Falke 45, 338-342.
Kohl F. (2011)
Kormorane und Fische Naturschutz und Fischerei - Fakten und Argumente zu einem lösbaren Problem. Österreichisches Kuratorium für Fischerei und Gewässerschutz. 166 S.
Koed A., Baktoft H., & Bak B.D. (2006)
Causes of mortality of Atlantic salmon (Salmo salar) and brown trout (Salmo trutta) smolts in a restored river and its estuary. River Research & Applications, 22, 69-78.
Koffijberg K. & van Eerden M.R. (1995)
Sexual dimorphism in the cormorant Phalacrocorax carbo cinensis - Possible implications for differences in structural size. Ardea 83, 37-46.
Landesfischereiverband Baden-Württemberg e. V. (2010)
Der Kormoran - Eine heimische Art?
Liordos V. & Goutner V. (2008)
Sex determination of great cormorants (Phalacrocorax carbo sinensis) using morphometric measurements. Waterbirds 31, 203-210.
Ravn H.D. & Jepsen N (2016)
Stallingen i Kongeåen - et telemetristudie med fokus på prædation. DTU Aqua-rapport 314.
Ridgway M.S. (2010)
A review of estimates of daily energy expenditure and food intake in cormorants (Phalacrocorax spp.). Journal of Great Lakes Research 36, 93-99.
Rutschke E. (1998) Der Kormoran: Biologie, Ökologie, Schadabwehr. Parey, Berlin.
Schneider J., Jörgensen L, Krau F. & Fetthauer M. (2015)
WRRL-Qualitätsindikator Fischfauna und Kormoranfraßdruck - wenn trophische Störung Strukturgüte schlägt. Korrespondenz Wasserwirtschaft 8, 755-761.
Schwevers U. & Adam B. (2003)
Zum Einfluss des Kormorans auf die Fischbestände der Unteren Eder. Fischer und Teichwirt 54, 171-173.
Skov C., Jepsen N., Baktoft H., Jansen T., Pedersen S., & Koed A. (2014)
Cormorant predation on PIT-‐tagged lake fish. Journal of Limnology 73, 177-186.
Staub E. (1997)
Cormorant Phalacrocorax carbo predation and conflicts with species conservation and fisheries in Switzerland. Ekologia Polska 45, 309–310.
Stemmer B. (2012)
Flexibilität des Kormorans (Phalacrocorax carbo) beim Nahrungserwerb kann regulierende Maßnahmen zur Erhaltung von Fischbeständen notwendig machen. Acta Ornithoecologica 7, 107-115.
Strod T., Arad Z., Izhaki I., & Katzir G. (2004)
Cormorants keep their power: visual resolution in a pursuitdiving bird under amphibious and turbid conditions. Current biology 14, 376-377.
Strod T., Izhaki I., Arad Z., Weihs D., & Katzir G. (2003)
Cormorants Phalacrocorax carbo swallow fish under water. Vogelwelt 124 Supplement, 270.
Südbeck P. (1997)
Zum aktuellen Status des Kormorans Phalacrocorax carbo sinensis in Niedersachsen - Ergebnisse landesweiter Schlafplatzzählungen sowie Angaben zur Brutbestandsentwicklung. Vogelkundliche Berichte aus Niedersachsen 29, 63-84.
White C.R., Day N., Butler P.J., & Martin G.R. (2007)
Vision and foraging in cormorants: More like herons than hawks? PLoS ONE 2, e639.
White C.R., Martin G.R., & Butler P.J. (2008)
Wing-spreading, wing-drying and food-warming in great cormorants Phalacrocorax carbo. Journal of Avian Biology 39, 576-578.
Winfield I.J., Crawshaw D.H., & Durie N.C. (2003)
Management of the cormorant, Phalacrocorax carbo, and endangered whitefish, Coregonus lavaretus, populations of Haweswater, UK. Interactions Between Fish and Birds: Implications for Management (ed. by I.G. Cowx), pp. 335-344. Blackwell Publishing Ltd.
Wunner U. & Wismath P. (2004)
Zerstörung der Fischbestände der Amper durch Kormorane. Fischer & Teichwirt 4, 609-612.
Wziatek B., Martyniak A., Szymanska U., Kozlowska K., & Dostanti D. (2003)
Composition of the great cormorant Phalacrocorax carbo sinensis diet in the Drawien National Park, NW-Poland. Vogelwelt 124 Supplement, 291-295.
Quelle - Anglerverband Niedersachsen: http://www.blinker.de/wp-content/uploads/2016/11/2016-11-28_AVN-Faktencheck_Kormoran_final_web.pdf